Paniculitis granulomatosa sarcoidal asociada a inhibidores de
puntos de control inmunológico: un evento adverso cutáneo
inmunomediado poco frecuente
Anamá Di Prinzio
https://orcid.org/0000-0003-2660-0357
Servicio de Dermatología. Hospital Italiano de Buenos Aires.
Argentina
Julia Riganti
https://orcid.org/0000-0001-5382-1863
Servicio de Dermatología. Hospital Italiano de Buenos Aires.
Argentina
Ana C. Torre
https://orcid.org/0000-0001-9670-6566
Servicio de Dermatología. Hospital Italiano de Buenos Aires.
Argentina
Luis D. Mazzuoccolo
https://orcid.org/0000-0002-6315-7916
Servicio de Dermatología. Hospital Italiano de Buenos Aires.
Argentina
Autor para correspondencia:
anama.diprinzio@hospitalitaliano.org.ar, Di Prinzio A.
Recibido:16/05/2024
Aceptado:4/12/2024
En línea:7/03/2025
DOI:
http://doi.org/10.51987/rev.hosp.ital.b.aires.v45i1.354
Cómo citar:
Di Prinzio A, Riganti J, Torre AC, Mazzuoccolo LD. Paniculitis
granulomatosa sarcoidal asociada a inhibidores de puntos de
control inmunológico: un evento adverso cutáneo inmunomediado
poco frecuente. Rev. Hosp. Ital. B.Aires.
2025;45(1):e0000354.
ISSN (en línea):2314-3312 | Licencia Creative
Commons:BY-NC-SA 4.0
RESUMEN
Los medicamentos inhibidores de puntos de control inmunológico
(IPI), o inhibidores del checkpoint, se han asociado a diversos
efectos adversos inflamatorios y autoinmunes, denominados eventos
adversos inmunomediados (irAE). Entre los irAE, las toxicidades
dermatológicas son las más prevalentes; los más frecuentes son el
exantema maculopapular, el prurito y las erupciones de tipo
liquenoide y psoriasiforme.
Palabras clave:
sarcoidosis, cáncer, inmunoterapia, punto de control
inmunitario.
Sarcoidal Granulomatous Panniculitis Associated with Immune
Checkpoint Inhibitors: A Rare Immune-Mediated Cutaneous Adverse
Event
ABSTRACT
Immune checkpoint inhibitors (ICIs), or checkpoint inhibitors,
have been associated with various inflammatory and autoimmune
adverse effects, known as immune- related adverse events (irAEs).
Among irAEs, dermatological toxicities are the most prevalent,
with maculopapular rash, pruritus, and lichenoid and psoriasiform
eruptions being the most common.
Key words:
sarcoidosis, cancer, immunotherapy, immune checkpoint.
INTRODUCCIÓN
El CTLA-4 y el PD-1 son puntos de control del sistema inmunológico
que regulan su funcionamiento para proteger al organismo de su
activación anómala y sus consecuencias. En las neoplasias
malignas, su función puede estar alterada por el microambiente
tumoral, el cual favorece la evasión de las células del cáncer al
control inmunitario. Los fármacos inhibidores de los puntos de
control inmunitario (IPI) o inhibidores del checkpoint,
como el ipilimumab, el pembrolizumab, el nivolumab y el avelumab,
entre otros, constituyen un importante avance en el tratamiento
oncológico. Sin embargo, debido a su mecanismo de acción único, su
uso se ha vinculado con un conjunto de efectos adversos
denominados inmunomediados (irAE). Los IrAE cutáneos aparecen en
un porcentaje variable de los pacientes (0,65-22%).1-7
Los más frecuentes son el exantema maculopapular y el prurito,
seguidos por las erupciones liquenoides, psoriasiformes y el
penfigoide ampollar. 4-7 Se comunica el caso de un
paciente que presentó sarcoidosis cutánea durante el tratamiento
con pembrolizumab, el cual es un IrAE infrecuente.
CASO CLÍNICO
Paciente de sexo masculino, de 58 años, con cáncer de pulmón
estadio IV en tratamiento con pemetrexed, pembrolizumab y
carboplatino. Consultó por lesiones cutáneas de 30 días de
evolución, que comenzaron 2 meses después del inicio de la
medicación. Al examen físico se observaban placas
eritematoamarronadas, ovoides, de 5 a 10 cm de diámetro, de
límites difusos, sobre las cuales asentaban nódulos de 1 a 2 cm de
diámetro, asintomáticos, localizadas en la cara anterior y externa
de ambas piernas (Fig. 1). Los estudios de laboratorio
evidenciaron resultados dentro de los parámetros normales. Los
cultivos de piel para bacterias, micobacterias y hongos fueron
negativos y descartaron infección. La histopatología de las
lesiones cutáneas reveló una paniculitis granulomatosa de tipo
sarcoidal (Fig. 2). La tomografía computarizada de tórax evidenció
un nodulillo de 3 mm en lóbulo superior izquierdo que no se había
observado en estudios previos. Si bien esto podía corresponder a
progresión de la enfermedad oncológica, no era posible descartar
que fuera sarcoidosis, dada la elevada asociación del compromiso
cutáneo y pulmonar en esta patología. El cuadro se interpretó como
enfermedad granulomatosa sarcoidal asociada a pembrolizumab sobre
la base de los informes recientes y de que, hasta la fecha, no se
encontraron comunicaciones de asociación de este tipo de
enfermedades con el carboplatino o el pemetrexed. Una manera de
realizar esta distinción podría haber sido mediante una prueba
terapéutica con corticoides sistémicos. Sin embargo, ante la
posibilidad de que esta interfiriera con el tratamiento
oncológico, se decidió no realizarla. Se indicó clobetasol 0,05%
en crema una vez al día durante 1 mes y luego tacrolimus 0,1% en
ungüento. Evolucionó con resolución parcial de las lesiones
cutáneas en 2 meses, pero también con progresión de su enfermedad
oncológica, con deterioro del estado general, aumento del número
de metástasis a distancia, y falleció un año después.
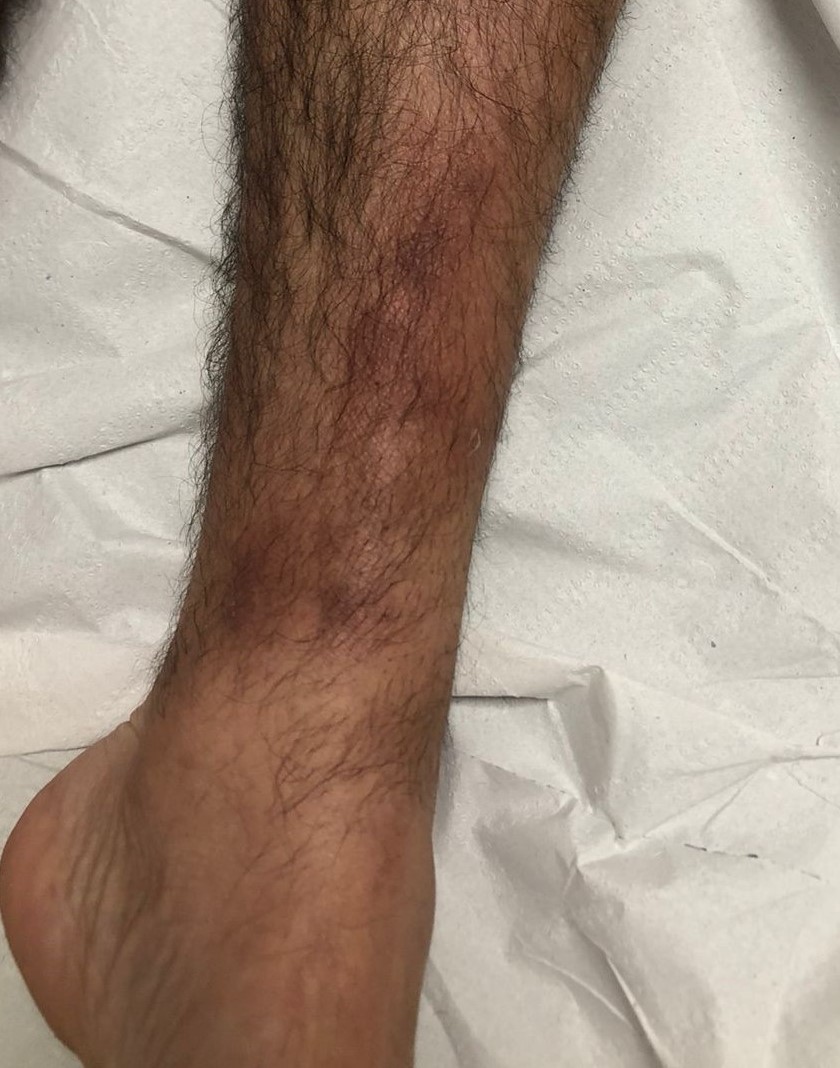
Figura 1.
Placas eritematosas sobre las que asientan nódulos de 1 a 2 cm
de diámetro, asintomáticos, en la cara anterior de la pierna
derecha.
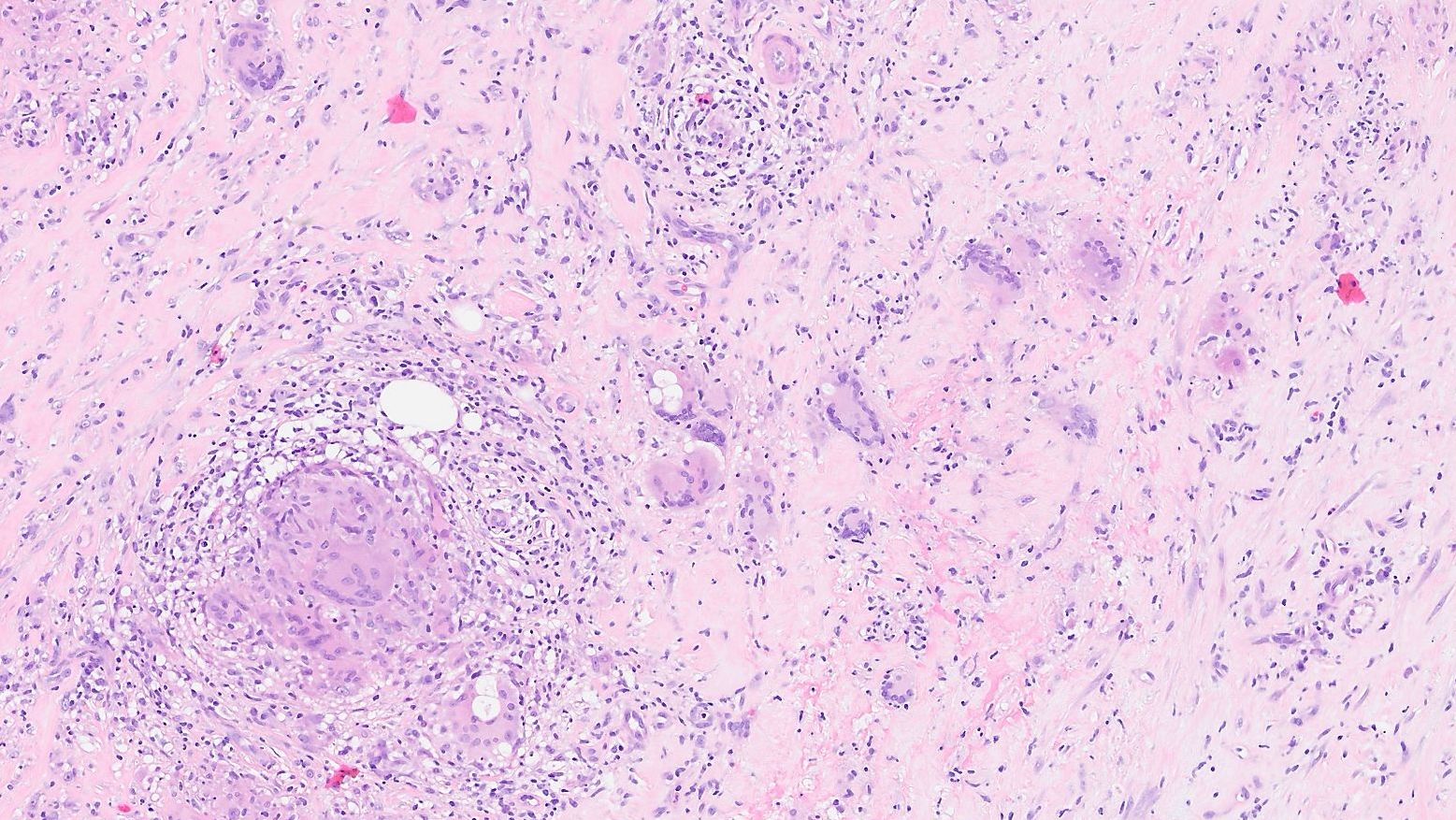
Figura 2.
Paniculitis granulomatosa de tipo sarcoidal (Hematoxilina y
eosina, ×400).
DISCUCIÓN
La sarcoidosis cutánea es un IrAE infrecuente de los IPI.4-6
Se propone que su aparición podría estar relacionada con un
incremento de linfocitos Th1 y Th17 debido al bloqueo del CTLA-4 o
a una reacción paradojal a los anti-PD-1, debido a que se ha
observado que los pacientes con sarcoidosis tienen una expresión
aumentada de PD-1 en las células T.3,8
La sarcoidosis asociada a ICI afecta a ambos sexos por igual y la
edad media de diagnóstico es 54 años en los hombres y 57 en las
mujeres. Las neoplasias subyacentes incluyeron principalmente el
melanoma (75%), seguido de otros cánceres. A su vez, se destaca
que ha sido comunicada con mayor frecuencia con anti-PD-1 en
monoterapia y en esquemas combinados, que con anti-CTLA-4
ipilimumab como monoterapia. 8 La mediana de tiempo transcurrida
entre el inicio de tratamiento y el desarrollo de la sarcoidosis
observada es de 2 a 3 meses (rango 2- 29 meses).4-6,9
La enfermedad se suele presentar con afectación de los ganglios
linfáticos mediastinales y pulmonar. La incidencia de compromiso
cutáneo es desconocida y la afectación exclusiva de la piel parece
ser excepcional.8,10 Este suele manifestarse con
nódulos eritematosos (similar a una paniculitis o eritema nodoso),
como en el caso comunicado, o con una erupción maculopapular
inespecífica. Con menor frecuencia, su presentación es atípica,
con afectación del rostro, de piel tatuada o cicatrices.8,9
El diagnóstico de la sarcoidosis cutánea y su asociación con
enfermedad sistémica se realiza sobre la base del cuadro clínico,
los estudios complementarios y los hallazgos de la histología de
las lesiones cutáneas (Tabla 1). El estudio histopatológico de la
piel afectada revela granulomas epitelioides no caseificantes.9
Es fundamental la exclusión de otros diagnósticos diferenciales.
Tabla 1.
Evaluación de pacientes con diagnóstico de sarcoidosis cutánea
para valorar afectación sistémica. Tomada y modificada de
Abdelghaffar M y cols.11
- Historia clínica detallada
- Examen físico completo
-
Estudios de laboratorio
- Hemograma completo
- Pruebas de función hepática y renal
-
Glucemia basal, ionograma sérico, calcemia, fosfatemia y
magnesemia
- QuantiFERON o PPD 2 UT de ser posible
- TSH
- 25-hidroxivitamina D
-
Dosaje sérico de enzima convertidora de angiotensina o del
biomarcador IL-2R soluble [CD25]
-
Evaluación pulmonar
- Radiografía de tórax de frente y perfil
- Pruebas de función pulmonar
- Considerar la derivación a Neumología
-
Evaluación cardíaca
- Electrocardiograma
-
Si el paciente presenta antecedentes de presíncope, síncope,
mareos o palpitaciones, se recomienda derivar a Cardiología
-
Evaluación oftalmológica
- Considerar la derivación a Oftalmología
-
Considere la derivación a otros especialistas, según lo recuperado
a través del interrogatorio, la anamnesis y los estudios de
laboratorio
-
Seguimiento de los pacientes para detectar progresión a afectación
sistémica
- Anamnesis y examen físico completo anual
-
Laboratorio anual con hemograma y estudio metabólico completo
-
Dosaje de enzima convertidora de angiotensina o del
biomarcador de la enfermedad si cambian los síntomas
-
Considerar la derivación a un especialista si cambian los
síntomas
El tratamiento recomendado en los casos con afectación cutánea
localizada son los corticoides tópicos de alta potencia, mientras
que en los casos con lesiones cutáneas extensas, compromiso
pulmonar sintomático o afectación de otros órganos se sugieren los
corticoides sistémicos (CS) y suspender los IPI. Su reintroducción
se debe considerar luego del control del cuadro y la reducción de
la dosis de CS ≤ 10 mg/kg/día de meprednisona o equivalentes.2-4
El pronóstico de este irAE es variable y depende del estado
clínico del paciente y la gravedad del cuadro.10 Si
bien se ha observado que el desarrollo de determinados IrAE podría
estar relacionado con una mejor respuesta tumoral, se desconoce si
esto sucede en los pacientes con sarcoidosis asociada a IPI dado
lo infrecuente de su presentación.2-4 En un estudio
reciente, Chanson y cols. incluyeron 32 pacientes con sarcoidosis
asociada a IPI. Observaron que este cuadro parece tener un
comportamiento más benigno que el de la sarcoidosis idiopática, ya
que se presenta con compromiso pulmonar más leve, suele ser
asintomática, evoluciona con resolución espontánea y se asocia con
una menor necesidad de terapia sistémica. Su aparición no
implicaría necesariamente la suspensión de la inmunoterapia. El
motivo de esta presentación benigna podría estar relacionado con
el estrecho seguimiento con estudios de imágenes que se realiza en
estos pacientes, lo que facilitaría un diagnóstico temprano de la
enfermedad.8
Son necesarios un mayor informe de casos y nuevos trabajos de
investigación para caracterizar a la población que padece este
evento adverso y conocer sus implicaciones en el pronóstico de los
pacientes.1-4
Contribuciones de las autoras:
Estudio del caso clínico, diseño y redacción del trabajo (ADP),
Estudio delcaso clínico. Particupación en el tratamiento del
paciente y toma de decisiones del caso (JR), Estudio del caso
clínico, participación en la terapéutica del paciente, redacción
de información del manuscrito y revisión (ACT), Revisión final del
trabajo y aportes sobre el manuscrito (LDM).
Conflictos de intereses:
Los autores declaran no poseer conflictos de intereses
relacionados al contenido del presente trabajo.
Financiamiento:
Los autores declaran que este estudio no recibió financiamiento
de ninguna fuente externa.
Referencias
-
Trilleras-Gómez AP, Hull KJ, Drew DZ. Case report and review of 7
similar cases in the literature: cutaneous sarcoidosis as side
effect of pembrolizumab plus chemotherapy in stage IV squamous
cell carcinoma of lung. J Immunother. 2021;44(2):90-94.
https://doi.org/10.1097/CJI.0000000000000351
-
Torres-Jiménez J, Esteban-Villarrubia J, García-Abellás P, et al.
Sarcoidosis- like reactions in cancer patients treated with immune
checkpoint inhibitors: experience in a Spanish hospital. Clin
Transl Oncol. 2021;23(7):1474-1480.
https://doi.org/10.1007/s12094-020-02546-w
-
Chorti E, Kanaki T, Zimmer L, et al. Drug-induced sarcoidosis-like
reaction in adjuvant immunotherapy: Increased rate and mimicker of
metastasis. Eur J Cancer. 2020;131:18-26.
https://doi.org/10.1016/j.ejca.2020.02.024
-
Juan-Carpena J, Palazón-Cabanes JC, Blanes-Martínez M. Revisión
sistemática de los efectos adversos cutáneos causados por fármacos
inhibidores de los puntos de control inmunitario: características,
manejo y pronóstico. Actas Dermosifiologr. 2022;113(4):376-387.
https://doi.org/10.1016/j.ad.2021.09.005
-
Suozzi KC, Stahl M, Ko CJ, et al. Immune-related sarcoidosis
observed in combination ipilimumab and nivolumab therapy. JAAD
Case Rep. 2016;2(3):264-268.
https://doi.org/10.1016/j.jdcr.2016.05.002
-
Martínez Leboráns L, Esteve Martínez A, Victoria Martínez AM, et
al. Cutaneous sarcoidosis in a melanoma patient under Ipilimumab
therapy. Dermatol Ther. 2016;29(5):306-308.
https://doi.org/10.1111/dth.12380
-
Birnbaum MR, Ma MW, Fleisig S, et al. Nivolumab-related cutaneous
sarcoidosis in a patient with lung adenocarcinoma. JAAD Case Rep.
2017;3(3):208-211.
https://doi.org/10.1016/j.jdcr.2017.02.015
-
Chanson N, Ramos-Casals M, Pundole X, et al. Immune checkpoint
inhibitor- associated sarcoidosis: a usually benign disease that
does not require immunotherapy discontinuation. Eur J Cancer.
2021;158:208-216.
https://doi.org/10.1016/j.ejca.2021.05.041
-
Sibaud V. Dermatologic reactions to immune checkpoint inhibitors :
skin toxicities and immunotherapy. Am J Clin Dermatol.
2018;19(3):345-361.
https://doi.org/10.1007/s40257-017-0336-3
-
Haanen JBAG, Carbonnel F, Robert C, et al. Management of
toxicities from immunotherapy: ESMO Clinical Practice Guidelines
for diagnosis, treatment and follow-up. Ann Oncol.
2017;28(suppl_4):iv119-iv142.
https://doi.org/10.1093/annonc/mdx225. Errata en: Ann Oncol.
2018;29(Suppl 4):iv264-iv266.
https://doi.org/10.1093/annonc/mdy162
-
Abdelghaffar M, Hwang E, Damsky W. Cutaneous sarcoidosis. Clin
Chest Med. 2024;45(1):71-89.
https://doi.org/10.1016/j.ccm.2023.08.004

